Mortalin: Molekul Target Terobosan dalam Terapi Kanker
 Image by jcomp on Freepik
Image by jcomp on FreepikMortalin merupakan senyawa tak terinduksi yang merupakan anggota keluarga protein heat shock 70 kDa (HSP70) (Yoon et al., 2022). Ia mengikat p53 dalam sitoplasma sel kanker dan mencegahnya berpindah ke nukleus, sehingga mengganggu banyak fungsinya, termasuk duplikasi sentrosom, aktivasi transkripsi, dan apoptosis (Lu et al., 2011). Hasilnya, mortalin merupakan indikator prognostik yang menjanjikan dan molekul target untuk terapi kanker lambung, khususnya pada tumor dengan p53 normal (Elwakeel, 2022).
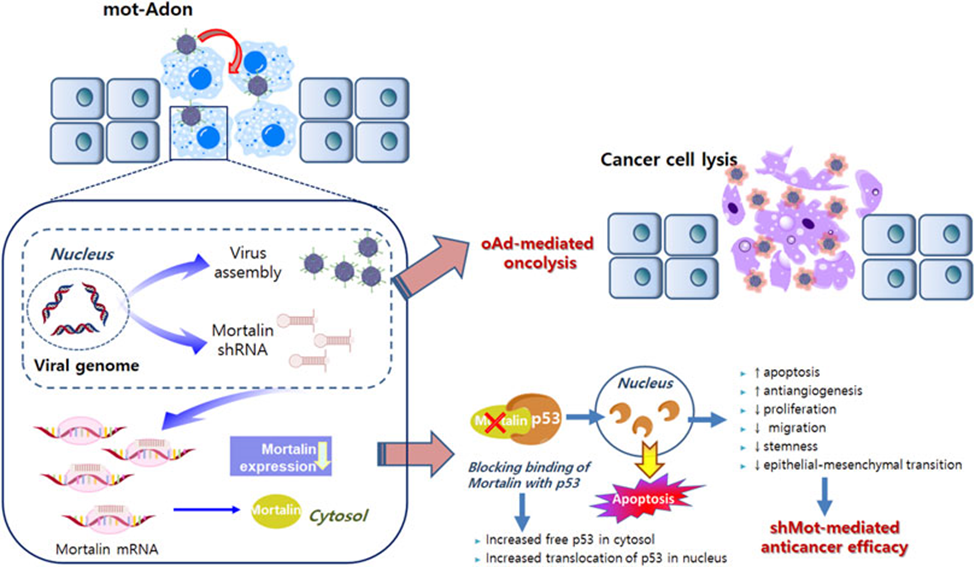
Mortalin berinteraksi dengan banyak protein dan dikaitkan dengan berbagai jalur molekuler berdasarkan lokalisasi subselulernya, termasuk penekan tumor p53, faktor pertumbuhan fibroblas-1, reseptor interleukin-1 tipe 1, protein yang diatur glukosa 94, dan translocase mitokondria bagian dalam. membran (TIM)-44 dan TIM23 (Kaul S et al., 2007).
Mortalin biasanya diekspresikan secara berlebihan pada kanker pada manusia. Ini juga merangsang pertumbuhan, migrasi, batang, transisi epitel-mesenkim, dan angiogenesis dalam sel kanker melalui sejumlah jalur sinyal (Yun et al., 2017).
Banyak jenis kanker, termasuk leukemia, kanker otak, adenokarsinoma kolorektal, dan karsinoma hepatoseluler, telah dikaitkan dengan pengayaan mortalin (Hu et al., 2016). Transformasi ganas dan kelangsungan hidup pasien yang buruk dikaitkan dengan ekspresi berlebih mortalin pada adenokarsinoma kolorektal (Jin et al., 2016). Selain itu, metastasis dan kekambuhan tumor dini dikaitkan dengan kanker hati dengan peningkatan ekspresi mortalin (Elwakeel et al., 2021).
Mortalin mempunyai dampak yang besar terhadap kanker lambung dengan p53 tanpa mutasi. Oleh karena itu, ini merupakan molekul target untuk pengobatan kanker lambung, serta merupakan faktor prognostik yang menjanjikan, terutama pada tumor dengan p53 normal. Jika p53 diinteraksikan dengan mortalin, yang terjadi adalah sel kanker menjadi apoptosis dan menghentikan siklus sel, sehingga aman untuk sel normal (Widodo, 2015).
Fungsi dan Potensi dari Mortalin
Fungsi potensial mortalin serta jalur molekuler yang mendasari pembentukan dan perkembangan kanker ovarium karena telah diamati dan disarankan bahwa ekspresi berlebih dapat membantu karsinogenesis (Yoon et al., 2022). Gagasan bahwa membatasi ekspresi mortalin dapat menghasilkan strategi terapi baru untuk mengobati kanker ovarium manusia dikemukakan oleh temuan ini, yang menawarkan lebih banyak informasi tentang peran onkogenik molekul ini dalam mendorong karsinogenesis kanker ovarium (Ratjak et al., 2023).
Studi yang dilakukan secara in vitro menggunakan lini sel kanker telah menjelaskan potensi efek mortalin pada fungsi seluler yang terlibat dalam permulaan dan perkembangan kanker (Niu & Wang, 2015). Misalnya, beberapa penelitian menunjukkan bahwa ekspresi berlebih protein mortalin dalam sel kanker dapat meningkatkan kelangsungan hidup sel, mencegah kematian sel (apoptosis), dan mendorong resistensi terhadap berbagai pemicu stres, termasuk kemoterapi dan radiasi (Forma & Bryś, 2021). Potensi efek onkogenik molekul ini pada kanker juga telah diselidiki dalam penelitian in vivo yang menggunakan model hewan (Yun et al., 2017).
Referensi:
[1] Elwakeel A. (2022). Abrogating the Interaction Between p53 and Mortalin (Grp75/HSPA9/mtHsp70) for Cancer Therapy: The Story so far. Frontiers in cell and developmental biology, 10, 879632. https://doi.org/10.3389/fcell.2022.879632
[2] Elwakeel, A., Sari, A. N., Dhanjal, J. K., Meidinna, H. N., Sundar, D., Kaul, S. C., & Wadhwa, R. (2021). Mutant p53L194F Harboring Luminal-A Breast Cancer Cells Are Refractory to Apoptosis and Cell Cycle Arrest in Response to MortaparibPlus, a Multimodal Small Molecule Inhibitor. Cancers, 13(12), 3043. https://doi.org/10.3390/cancers13123043
[3] Forma, E., & Bryś, M. (2021). Anticancer Activity of Propolis and Its Compounds. Nutrients, 13(8), 2594. https://doi.org/10.3390/nu13082594
[4] Hu, Y., Yang, L., Yang, Y., Han, Y., Wang, Y., Liu, W., & Zuo, J. (2016). Oncogenic role of mortalin contributes to ovarian tumorigenesis by activating the MAPK-ERK pathway. Journal of cellular and molecular medicine, 20(11), 2111–2121. https://doi.org/10.1111/jcmm.12905
[5] Jin, H., Ji, M., Chen, L., Liu, Q., Che, S., Xu, M., & Lin, Z. (2016). The clinicopathological significance of Mortalin overexpression in invasive ductal carcinoma of breast. Journal of experimental & clinical cancer research : CR, 35, 42. https://doi.org/10.1186/s13046-016-0316-0
[6] Kaul, S. C., Deocaris, C. C., & Wadhwa, R. (2007). Three faces of mortalin: a housekeeper, guardian and killer. Experimental gerontology, 42(4), 263–274. https://doi.org/10.1016/j.exger.2006.10.020
[7] Lu, W. J., Lee, N. P., Kaul, S. C., Lan, F., Poon, R. T., Wadhwa, R., & Luk, J. M. (2011). Mortalin-p53 interaction in cancer cells is stress dependent and constitutes a selective target for cancer therapy. Cell death and differentiation, 18(6), 1046–1056. https://doi.org/10.1038/cdd.2010.177
[8] Niu, N., & Wang, L. (2015). In vitro human cell line models to predict clinical response to anticancer drugs. Pharmacogenomics, 16(3), 273–285. https://doi.org/10.2217/pgs.14.170
[9] Rajtak, A., Czerwonka, A., Pitter, M., Kotarski, J., & Okła, K. (2023). Clinical Relevance of Mortalin in Ovarian Cancer Patients. Cells, 12(5), 701. https://doi.org/10.3390/cells12050701
[10] Widodo. (2015). Analisis penghambatan aktivitas mortalin dengan senyawa herbal Indonesia untuk skrening anti kanker melalui in silico. Retrieved from https://media.neliti.com/media/publications/169365-ID-analisis-penghambatan-aktivitas-mortalin.pdf
[11] Yoon, A. R., Wadhwa, R., Kaul, S. C., & Yun, C. O. (2022). Why is Mortalin a Potential Therapeutic Target for Cancer?. Frontiers in cell and developmental biology, 10, 914540. https://doi.org/10.3389/fcell.2022.914540
[12] Yun, C. O., Bhargava, P., Na, Y., Lee, J. S., Ryu, J., Kaul, S. C., & Wadhwa, R. (2017). Relevance of mortalin to cancer cell stemness and cancer therapy. Scientific reports, 7, 42016. https://doi.org/10.1038/srep42016













No Comments